克服生活中的压力
撰文/萨波斯基( ),美国史丹佛大学生物科学及教授,兼非洲肯亚国立博物馆研究员,在肯亚研究野生狒狒族群已有20年历史。他于1984年在美国洛克斐勒大学取得神经内分泌学博士学位,研究兴趣包括神经死亡、基因以及灵长类生理学。
摄影/萨泽诺(James Salzano)
翻译/,美国韦恩州立大学生理学系研究学者。近期译作有《睡眠的迷人世界》、《DNA图解小百科》、《生命的线索》等。
压力的恶性循环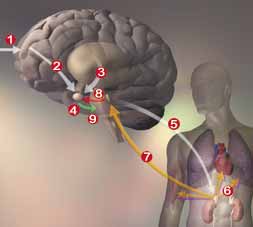 传导压力的线路相当分歧,有许多脑区参与并形成反馈回路,有时会大幅强化某个反应。当实际或想像中的威胁活化了大脑皮质(1)的感觉及高级推理中枢,也就开启了这个过程(图中有所简化);接着,大脑皮质将讯息送给杏仁体(2),它是压力反应当中主要的调解者。某个前意识的讯息也可能从不同路线先行引发了杏仁体的活性(3);杏仁体释放出肾皮释素,刺激了脑干(4),并经由脊髓活化了交感神经系统(5)。肾上腺受到交感神经的刺激,就产生压力激素-肾上腺素;同时还有另一条不同的路线,引发肾上腺释放糖皮质素。这两种激素作用在肌肉、心脏以及肺脏,让身体准备好进行“战或逃”反应(6)。如果压力持久不消,糖皮质素会引起蓝斑核(7)释放正肾上腺素,然后传递到杏仁体(8),导致更多肾皮释素的生成(9),而再度活化进行中的压力线路。
传导压力的线路相当分歧,有许多脑区参与并形成反馈回路,有时会大幅强化某个反应。当实际或想像中的威胁活化了大脑皮质(1)的感觉及高级推理中枢,也就开启了这个过程(图中有所简化);接着,大脑皮质将讯息送给杏仁体(2),它是压力反应当中主要的调解者。某个前意识的讯息也可能从不同路线先行引发了杏仁体的活性(3);杏仁体释放出肾皮释素,刺激了脑干(4),并经由脊髓活化了交感神经系统(5)。肾上腺受到交感神经的刺激,就产生压力激素-肾上腺素;同时还有另一条不同的路线,引发肾上腺释放糖皮质素。这两种激素作用在肌肉、心脏以及肺脏,让身体准备好进行“战或逃”反应(6)。如果压力持久不消,糖皮质素会引起蓝斑核(7)释放正肾上腺素,然后传递到杏仁体(8),导致更多肾皮释素的生成(9),而再度活化进行中的压力线路。
压力导致
的感觉可以像是无可救药的亢进,反之,重郁症的特征则是无助、绝望、无法做任何事情的虚脱感(精神性运动迟滞),以及丧失快感。因此之故,抑郁具有不同的生物特性,也需要不同的医疗策略。不过,抑郁与压力之间也有关联,而且证据相当充份。首先,心理压力会有失去控制以及预期性的感觉,这对抑郁来说也是个正确的描述;其次,在抑郁这个毛病的发生早期,每次抑郁发作之前似乎都会有重大的压力事件发生;最后,用来控制像风湿性关节炎这种病症的糖皮质素,可能引起抑郁。压力引发抑郁的方式之一,是作用于脑中负责情绪及快感的通道。一开始,长期接触糖皮质素会造成蓝斑核神经元当中正肾上腺素的含量下降,这很可能代表该动物(或人)会变得较不专心、警觉性下降、较不爱动,于是就出现了精神性运动迟滞。
持续的压力也会降低血清张力素的含量,以及额叶皮质中血清张力素受体的数目;血清张力素除了其他的作用外,对于情绪及睡眠周期的调节也可能相当重要。抵达额叶皮质的血清张力素通常来自中脑的缝合核,而该构造与蓝斑核之间也会互相作用。读者或许已经看出接下来我要谈的:正常情况下,血清张力素会刺激蓝斑核分泌正肾上腺素;当血清张力素的量变少之后,正肾上腺素的分泌也跟着变少,使得先前由于糖皮质素无止尽的轰炸造成的正肾上腺素短缺情况更形恶化。
压力对于多巴胺这条快感通路的影响方式,乍看起来似乎与直觉不合。温和与短暂的压力,以及随后出现的糖皮质素,增加了快感通路当中多巴胺的释放;这条通路从中脑的腹被盖区通往前脑的依核以及额叶皮质。在温和或短暂的压力下,个体接受了短暂且不那么严格的挑战,此时拥有更多的多巴胺,可制造出幸福的感觉。对人类或老鼠而言,这种情况所伴随的工作是不那么简单,但成功的希望还满大的;换句话说,那就是我们一般所说的“刺激”。只不过在长期接触糖皮质素之下,多巴胺的生成受到抑制,快乐之感也就逐渐消逝。
杏仁体与抑郁似乎也有关联,这点并会不让人感到讶异。美国国家精神健康研究院的德瑞维兹(Wayne
Drevets)报告说,从脑部造影可以看出,抑郁症患者的杏仁体对于悲伤脸孔要比愤怒脸孔的反应来得强。还有,焦虑时出现的自主神经兴奋性增强(相信是由杏仁体所主导),也经常出现在抑郁患者的身上。这个现象乍看之下让人有些困惑,因为焦虑的特征是出现一发不可收拾的战或逃讯号,反之,抑郁看起来则像是呆滞不动;只不过抑郁表现出来的无助,并非安静、被动的状态,他们内心的恐惧,可是鲜活、刺痛、耗费体力、让人分心且疲惫不堪的。抑郁的传统概念之一,是它代表了向内的攻击性,一场全然在内部进行的巨幅情绪争战;该病症的生理资料也支持了这个说法。
压力阻碍细胞的新生
同时,压力也会作用在海马;影响所及,就可能造成了抑郁症的一些显著特征,好比学习障碍及记忆困难。我在前面解释过,压力及糖皮质素能搅乱记忆于海马的成形,并造成海马神经元萎缩,丧失部份的分支。1980年代,包括我在内的好些实验室发现,糖皮质素能杀死海马的神经细胞,或是在遭逢癫痫或心跳停止这些对神经系统的威胁时,减弱神经细胞存活的能力。
压力甚至还会阻碍新的神经细胞生成。事实上,成年人的脑神经还能够制造一些新的神经细胞,这一点与长久以来的信念相反。这项革命性的观念是过去10年间才出现的,虽然其中某些发现还有所争议,但我们已很清楚:许多成年动物(包括人在内)脑中的嗅球及海马确有新神经元的形成(参见本期科学人杂志第32页〈脑子,请自行修复!〉)。包括学习、运动以及加强环境变化等做法,都刺激了海马当中的神经细胞新生;不过,压力及糖皮质素却造成抑制。
一如预期,抑郁症伴随着宣示型记忆的缺失,这项缺失不只是记不清楚新近发生创伤的细节,同时连日常生活、工作及学习上一般宣示型记忆的形成,也会受到干扰。最近有惊人的医学文献显示,罹患重郁症多年的病患,脑中海马的体积要比对照组的健康人士小上20~30%。并没有什么证据显示先天拥有较小海马的人容易罹患抑郁;反之,海马体积的缩小似乎是由于抑郁而产生的缺失。
目前,我们还不清楚海马体积的缩小,是由于神经细胞萎缩、死亡,或是无法产生神经新生所造成。让人难过的是,在抑郁症痊愈之后,这种海马体积的缩小以及至少某些认知功能的缺失,仍然存在。(学习与记忆功能是否需要有新的神经元生成,仍具高度争议性,因此,我们也还不清楚要是神经新生受到抑制,是否会造成认知的障碍。)
糖皮质素可能藉由抑制了一种称为“脑源神经营养因子”(BDNF)的化合物,来对海马造成作用,而BDNF可能有助于神经新生。一些已知的抗抑郁药增加了实验动物脑中BDNF的含量,并且刺激了海马的神经新生。这样的结果让一些科学家提出臆测:由于压力抑制了神经新生,并且降低了BDNF的量,因此引起了抑郁症的情绪症状。我个人认为,将海马功能的改变与这种疾病的各种面向都扯上关系,未免有一些牵强;不管怎么说,海马的这些改变对于重郁症常见的严重记忆缺失来说,很可能扮演着重要的角色。
治疗抑郁的新药
目前使用的这一代抗抑郁药增加了血清张力素、多巴胺及正肾上腺素的含量,还有非常多进行中的研究,寻求发展这些药物更有效的类型。不过,一些更新颖的治疗所针对的步骤,与压力及抑郁之间的互动关系更为紧密。
毫不令人讶异的是,这些研究有的集中在糖皮质素的作用;譬如好些安全、经核准用于临床的药物(为了其他目的),可暂时阻断肾上腺里糖皮质素的生成,或是阻断糖皮质素与其位于脑中的重要受体结合。有意思的是,主要用来阻断糖皮质素受体的化合物是RU486,这种药物因具有阻断子宫内黄体激素受体的能力,被当成“堕胎药”使用而名噪一时,且饱受争议。加拿大麦吉尔大学的墨菲(Beverly
Murphy)、加州大学旧金山分校的沃考维兹(Owen Wolkowitz)以及史丹佛大学的夏兹博格(Alan Schatzberg)的研究指出,RU486这种抗糖皮质素药物对于一批重郁症患者有用,这些人体内拥有极高含量的糖皮质素。由于这一批抑郁症患者对于较传统的抗抑郁药,通常表现最大的抗药性,因此上述发现也更让人兴奋。 一项治疗策略针对的是肾皮释素(右图中上)。一如焦虑症,抑郁通常都会有个反应过度的杏仁体以及交感神经系统,而肾皮释素是杏仁体与交感神经进行沟通的主要神经传递物;再者,将肾皮释素注入猴子的脑中,可引起类似抑郁的症状。这些发现促使了某些研究的进行,试图了解肾皮释素受体的阻断剂是否具有抗抑郁的作用;结果看来是有的,这一类的药物很可能在不久以后就会出现。
一项治疗策略针对的是肾皮释素(右图中上)。一如焦虑症,抑郁通常都会有个反应过度的杏仁体以及交感神经系统,而肾皮释素是杏仁体与交感神经进行沟通的主要神经传递物;再者,将肾皮释素注入猴子的脑中,可引起类似抑郁的症状。这些发现促使了某些研究的进行,试图了解肾皮释素受体的阻断剂是否具有抗抑郁的作用;结果看来是有的,这一类的药物很可能在不久以后就会出现。
研究人员运用阻断受体的相同策略,降低了P物质这种神经传递物的作用;P物质会作用于神经激肽-1(NK-1)的受体(右图最上)。1990年代初期,研究人员发现与NK-1结合的药物预防了某些层面的压力反应。在某项药物测试及好些动物实验中,P物质都具有抗抑郁剂的作用。
其他的做法则针对海马而来。有些研究人员将BDNF注入大鼠脑中,以对抗糖皮质素对于神经新生的抑制作用(右图中下)。我的实验室则使用基因来保护大鼠的海马免受压力的影响(右图最下),与我们在杏仁体所做的工作类似(目的是防止焦虑)。这些引进的新基因会受到糖皮质素的诱发,一旦活化表现之后,就会制造能够分解糖皮质素的酵素,结果是阻断了糖皮质素的有害作用。目前,我们正以动物进行这种疗法,看是否有用。
我想目前已经很清楚,焦虑与抑郁彼此相关;只不过一方处于随时警戒、另一方则处于长期无助的状态,看起来似乎相当不同。那么,压力在什么时候引起其中一种、而不是另外一种呢?这个问题的答案似乎是由压力期间的长短而定。【意犹未尽吗?欲阅读完整全文,请参阅2003年10月号年度脑专辑“驯服压力”一文。】
【延伸阅读】
许多人的情绪问题还没有严重到发展成抑郁症,不过平日仍然受到焦虑问题所苦。你想知道是什么原因引发焦虑吗?又要如何对抗焦虑的情绪?有没有比较有效的治疗或调适方法?详情请见本期《科学人》第84页〈驯服压力〉一文。
本文作者萨波斯基除了在科学研究有杰出成就,他也致力于撰写科普文章,他的著作《为什么斑马不会得胃溃疡?》(远流)便是讲述压力与相关疾病的关系,非常值得参考。
Gene Therapy in the Nervous System. Dora Y. Ho and Robert M. Sapolsky in
Scientific American; July 1997.
The End of Stress as We Know It. Bruce McEwen, with Elizabeth Norton Lasley.
Joseph Henry Press, Washington D.C., 2002.
Better Than Prozac. Samuel H. Barondes. Oxford University Press, 2003.1. 4